A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Hexakarbonyl molybdenu | |
|---|---|
 Strukturní vzorec | |
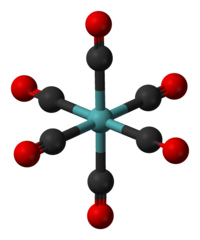 Model molekuly | |
| Obecné | |
| Systematický název | hexakarbonyl molybdenu |
| Funkční vzorec | Mo(CO)6 |
| Sumární vzorec | MoC6O6 |
| Vzhled | růžové krystaly |
| Identifikace | |
| Registrační číslo CAS | 13939-06-5 |
| EC-no (EINECS/ELINCS/NLP) | 237-713-3 |
| PubChem | 98885 |
| ChEBI | 30508 |
| SMILES | O=C=(=C=O)(=C=O)(=C=O)(=C=O)=C=O |
| InChI | InChI=1S/6CO.Mo/c6*1-2; |
| Vlastnosti | |
| Molární hmotnost | 264,02 g/mol |
| Teplota tání | 150 °C (423 K) |
| Teplota varu | 156 °C (429 K) |
| Hustota | 1,96 g/cm3 |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu a diethyletheru |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −989,1 kJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −2123,4 kJ/mol |
| Bezpečnost | |
| H-věty | H300 H310 H315 H319 H330 H413 |
| P-věty | P261 P271 P280 P304+340+311 P405 P501 |
Některá data mohou pocházet z datové položky. | |
Hexakarbonyl molybdenu je chemická sloučenina se vzorcem Mo(CO)6. Jedná se, podobně jako u hexakabonylů chromu a wolframu, o těkavou, na vzduchu stálou, pevnou látku obsahující kov v oxidačním čísle 0.
Struktura a vlastnosti
Mo(CO)6 má oktaedrickou geometrii vytvořenou šesti CO ligandy navázanými na atom Mo.
Mo(CO)6 se připravuje redukcí chloridů nebo oxidů molybdenu oxidem uhelnatým, díky jeho nízké ceně ale není nutná příprava v laboratoři.[1] Na vzduchu je stálý a v nepolárních organických rozpouštědlech jen málo rozpustný.
Výskyt
Mo(CO)6 byl nalezen na skládkách a v odpadních vodách, kde se vyskytují redukční anaerobní podmínky, napomáhající jeho tvorbě.[2]
Využití ve výzkumu
Hexakarbonyl molybdenu je často používán ve výzkumu.[3] Jeden nebo více CO ligandů lze nahradit jinými a vytvořit tak další komplexy.[4] Mo(CO)6, a obdobné sloučeniny se používají jako katalyzátory v organické syntéze, například při metatezích alkynů a Pausonových–Khandových reakcích.
Mo(CO)6 reaguje s 2,2′-bipyridinem za vzniku Mo(CO)4(bipy). Ultrafialovou fotolýzou roztoku Mo(CO)6 v tetrahydrofuranu vzniká Mo(CO)5(THF).
Mo(CO)4(piperidin)2" class="mw-editsection-visualeditor">editovat | editovat zdroj
Tepelnou reakcí Mo(CO)6 s piperidinem vzniká komplex Mo(CO)4(piperidin)2. Piperidinové ligandy jsou zde nestálé, což umožňuje navázání jiných ligandů za mírných podmínek; například reakcí s trifenylfosfinem ve vroucím dichlormethanu (teplota varu kolem 40 °C) se vytváří cis-Mo(CO)4(PPh3)2. Tento cis- komplex se v toluenu izomerizuje na trans-Mo(CO)4(PPh3)2.[5]
Mo(CO)3(MeCN)3editovat | editovat zdroj
Mo(CO)6 lze také přeměnit na tris(acetonitril)ový komplex; ten se dá použít jako zdroj Mo(CO)3, kde například reakcí s allylchloridem vzniká MoCl(allyl)(CO)2(MeCN)2, zatímco za přítomnosti KTp se tvoří anion MoTp(CO)3− a reakcí s cyklopentadienidem sodným MoCp(CO)3−. Tyto anionty reagují s řadou různých elektrofilů.[6] Podobným zdrojem Mo(CO)3 je trikarbonyl cykloheptatrienmolybdenu.
Zdroj atomů Moeditovat | editovat zdroj
Hexakarbonyl molybdenu se používá při depozici indukované paprskem elektronů, protože se snadno odpařuje a následně paprskem elektronů rozkládá za uvolnění atomů molybdenu.[7]
Bezpečnosteditovat | editovat zdroj
Stejně jako ostatní karbonyly kovů je Mo(CO)6 nebezpečný jakožto těkavý zdroj kovu a oxidu uhelnatého.
Odkazyeditovat | editovat zdroj
Referenceeditovat | editovat zdroj
V tomto článku byl použit překlad textu z článku Molybdenum hexacarbonyl na anglické Wikipedii.
- ↑ GREENWOOD, N. N.; EARNSHAW, A. Chemie prvků. 1. vyd. Praha: Informatorium, 1993. 1635 s. ISBN 80-85427-38-9. S. 1281–1283.
- ↑ J. Feldmann. Determination of Ni(CO)4, Fe(CO)5, Mo(CO)6, and W(CO)6 in Sewage Gas by Using Cryotrapping Gas Chromatography Inductively Coupled Plasma Mass Spectrometry. Journal of Environmental Monitoring. 1999, s. 33–37. DOI 10.1039/a807277i. PMID 11529076.
- ↑ J. W. Faller; K. M. Brummond; B. Mitasev. Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons, 2006. ISBN 0471936235. DOI 10.1002/047084289X.rh004.pub2. Kapitola Hexacarbonylmolybdenum.
- ↑ THE SYNTHESIS & SPECTROSCOPIC CHARACTERISATION OF METAL CARBONYL COMPLEXES online. Dostupné v archivu pořízeném z originálu dne 2008-03-09.
- ↑ D. J. Darensbourg; R. L. Kump. A Convenient Synthesis of cis-Mo(CO)4L2 Derivatives (L = Group 5a Ligand) and a Qualitative Study of Their Thermal Reactivity toward Ligand Dissociation. Inorganic Chemistry. 1978. DOI 10.1021/ic50187a062.
- ↑ C. Elschenbroich; A. Salzer. Organometallics: A Concise Introduction. s.l.: Wiley-VCH, 1992. ISBN 3-527-28165-7.
- ↑ S. J. Randolph; J. D. Fowlkes; P. D. Rack. Focused, Nanoscale Electron-Beam-Induced Deposition and Etching. Critical Reviews of Solid State and Materials Sciences. 2006, s. 55–89. DOI 10.1080/10408430600930438. Bibcode 2006CRSSM..31...55R.
Literaturaeditovat | editovat zdroj
- MARRADI, M. Synlett Spotlight 119: Molybdenum Hexacarbonyl Mo(CO)6. Synlett. 2005, s. 1195–1196. Dostupné online. DOI 10.1055/s-2005-865206.
- FELDMANN, J.; CULLEN, W. R. Occurrence of Volatile Transition Metal Compounds in Landfill Gas: Synthesis of Molybdenum and Tungsten Carbonyls in the Environment. Environ. Sci. Technol.. 1997, s. 2125–2129. DOI 10.1021/es960952y. Bibcode 1997EnST...31.2125F.
- FELDMANN, J.; GRÜMPING, R.; HIRNER, A. V. Determination of Volatile Metal and Metalloid Compounds in Gases from Domestic Waste Deposits with GC/ICP-MS. Fresenius' J. Anal. Chem.. 1994, s. 228–234. Dostupné online. DOI 10.1007/BF00322474. S2CID 95405500.
Externí odkazyeditovat | editovat zdroj
 Obrázky, zvuky či videa k tématu Hexakarbonyl molybdenu na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hexakarbonyl molybdenu na Wikimedia Commons
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antény
Chemické zdroje elektriny
Chladenie v elektrotechnike
Elektrická sústava automobilu
Elektrická trakcia
Elektrické prístroje
Elektrické súčiastky
Elektrické spotrebiče
Elektrické stroje
Čítanie (elektrotechnika)
Činný výkon
Štatistická dynamika
Živý vodič
Admitancia
Antiparalelné zapojenie
Asynchrónny motor
Blúdivý prúd
Bočník (elektrotechnika)
Diak (polovodičový prvok)
Displej s kvapalnými kryštálmi
Elektrická inštalácia
Elektrická rezonancia
Elektrická sila
Elektrická vodivosť
Elektrické zariadenie
Elektrický obvod
Elektrický zvonec
Elektroenergetika
Elektromer
Elektrometer
Elektromobil
Elektromotor
Elektromotorické napätie
Elektrotechnický náučný slovník
Elektrotechnika
Elektrotechnológia
Fázor
Faradayova klietka
Frekvencia (fyzika)
Graetzov mostík
Impedancia
Indukčnosť
Induktancia
Istič
Izolácia (elektrotechnika)
Izolant
Jadro vodiča
Jednobran
Jednosmerný prúd
Joulovo teplo
Katóda
Koaxiálny kábel
Kompenzácia účinníka
Konduktometria
Konektor (elektrotechnika)
Korónový výboj
Lanko (elektrotechnika)
Leptanie
Logické hradlo
Magnetická susceptibilita
Magnetizácia (veličina)
Merný elektrický odpor
Mobilné zariadenie
Napájací zdroj
Napäťový chránič
Napäťový násobič
Nortonova veta
Odpínač
Odpojovač
OLED
Olovený akumulátor
Paralelné zapojenie
Peltierov článok
Plošná hustota elektrického prúdu
Poistka (elektrotechnika)
Posuvný prúd
Prúdový chránič
Prenosové médium
Prieletový klystrón
Primárny elektrochemický článok
Reaktancia
Rekuperácia (dopravný prostriedok)
Relé
Reproduktorová výhybka
Rezistancia
Rozhranie (interface)
Sériové zapojenie
Seebeckov jav
Sekundárny elektrochemický článok
Settopbox
Skrat
Sonar
Spínač
Spínaný zdroj
Straty v mikropásikových vedeniach
Striedavý prúd
Stupeň ochrany krytom
Svetelná výbojka
Symetrizačný člen
Technická normalizácia
Tepelné relé
Tepelne vodivostný detektor
Termočlánok
Théveninova veta
Transformátor
Transformátor s fázovou reguláciou
Trojfázová sústava
Tuhá fáza (elektronika)
Tyratrón
Usmerňovač (elektrotechnika)
Uzemnenie
Uzol (vodiče)
Vírivý prúd
Výbojka
Varistor
Ventilátor
Vodič (elektrotechnika)
Voltov stĺp
Vstavaný systém
Zásuvka (elektrotechnika)
Zdroj (elektrotechnika)
Zisk antény
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk



